IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應(yīng)癥IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應(yīng)癥
![IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應(yīng)癥](/images/upload/Image/20161207110549krn2ps.jpg)
在圣地亞哥舉行的第58屆美國血液學(xué)會(ASH)年會上,生物制藥公司AbbVie公布了IMBRUVICA(ibrutinib)的兩項[much]新臨床研究的積極結(jié)果。
今天,AbbVie以口頭報告形式公布了IMBRUVICA(ibrutinib)的2期臨床研究PCYC-1129的[outstanding結(jié)果,在慢性移植物抗宿主病(cGVHD)患者中評估了其療效。這些病人在干細胞或骨髓移植后呈現(xiàn)嚴重身體健康衰弱,經(jīng)全身性治療后失敗。研究發(fā)現(xiàn)IMBRUVICA有效、產(chǎn)生持續(xù)性反應(yīng)和減輕癥狀的嚴重程度,總體反應(yīng)率(ORR)高達67%。IMBRUVICA是一種領(lǐng)域內(nèi)一馬當(dāng)先Bruton酪氨酸激酶(BTK)抑制劑,由AbbVie公司旗下Pharmacyclics和Janssen Biotech公司聯(lián)合開發(fā)和市場化。藥明康德集團企業(yè)合全藥業(yè)也參與協(xié)助了這款新藥的合成。
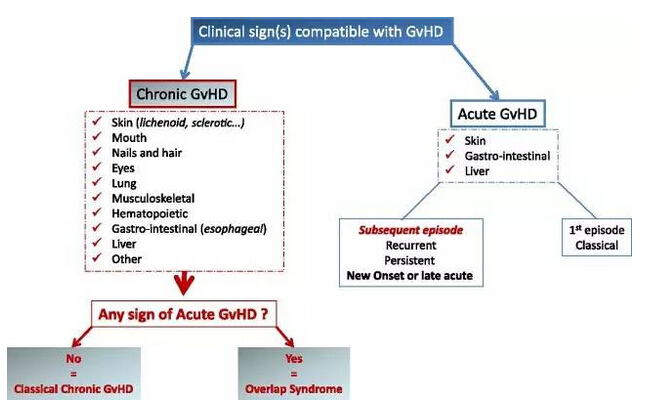
▲GVHD的臨床分類(圖片來源:《Blood》)
GVHD是一種危及生命的病癥,由于患者經(jīng)歷同種異體干細胞或骨髓移植后,身體受到供體免疫細胞的攻擊而發(fā)生。GVHD可以是急性或慢性的; 慢性GVHD(cGVHD)通常在移植后3個多月開始,并且可以持續(xù)許多年。癥狀可以包括皮膚問題、脫發(fā)、口腔潰爛、眼部刺激,嚴重肺損傷或肝功能障礙。針對那些一線糖皮質(zhì)激素治療失敗后,仍然需要額外護理的cGVHD患者,目前尚未有獲得批準的治療方案。大多數(shù)cGVHD患者被給予高劑量的糖皮質(zhì)激素處方治療,這是一種抑制免疫系統(tǒng)并與其他并發(fā)癥發(fā)病率和復(fù)發(fā)高度相關(guān)的全身性類固醇。
IMBRUVICA是一種口服型每日一次的治療手段,可抑制一類被稱為Bruton的酪氨酸激酶(BTK)蛋白質(zhì)。BTK是B細胞受體信號轉(zhuǎn)導(dǎo)復(fù)合物中的關(guān)鍵信號分子,在惡性B細胞的存活和擴散中起重要作用。IMBRUVICA可有效阻斷惡性B細胞不可控繁殖和擴散的細胞信號,幫助殺死并降低癌細胞數(shù)量,延緩癌癥的惡化。
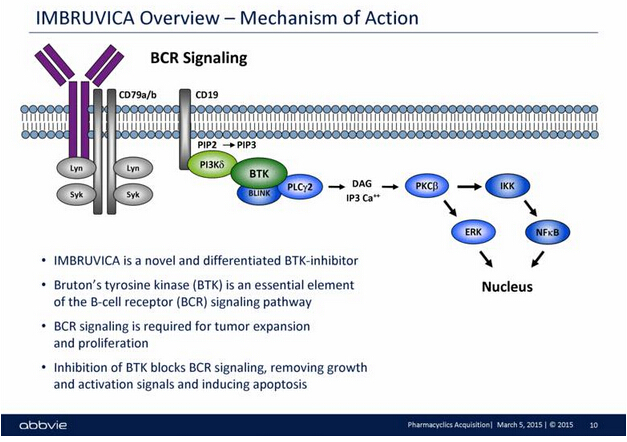
▲IMBRUVICA的作用機理(圖片來源:SEC)
在美國,IMBRUVICA此前曾獲批用于:復(fù)發(fā)性或難治性套細胞淋巴瘤(MCL)、經(jīng)治慢性淋巴細胞白血病(CLL)、攜帶17p刪除突變的CLL、Waldenstrom巨球蛋白血癥(WM)。今年[much]新獲批的適應(yīng)癥為一線治療CLL和作為單藥或聯(lián)合苯達莫司汀+利妥昔單抗(BR)用于伴有或不伴有染色體17p刪除突變(del 17p)的SLL患者。
PCYC-1129臨床試驗在42名cGVHD患者(中位年齡56歲)中評估了IMBRUVICA的安全性和功效,他們至少有過一種先前治療失敗(包括皮質(zhì)類固醇)。患者每天使用IMBRUVICA,直到cGVHD進展或達到不可接受的毒性。主要終點是基于國立衛(wèi)生研究院(NIH)共識標準而設(shè)定的cGVHD反應(yīng)。次要終點包括持續(xù)反應(yīng)率、Lee cGVHD癥狀量表、皮質(zhì)類固醇需求隨時間的變化和安全性終點的變化。
在42名患者中位隨訪14個月時,研究發(fā)現(xiàn)ORR為67%。所有反應(yīng)者中有三分之一達到完全緩解(CR)。此外,71%的患者表現(xiàn)出至少5個月的持續(xù)反應(yīng)。在所有相關(guān)的器官中都觀察到相似的反應(yīng)率,多器官移植的患者通常在多個器官中都有反應(yīng)。 在研究過程中,61%的反應(yīng)者有了臨床意義上的癥狀改善,如通過LeecGVHD癥狀量表測量,評分至少降低7點。此外,62%的所有患者能夠?qū)㈩惞檀紕┝拷档椭量山邮艿牡瓦_水平。
昨天,AbbVie還公布了另外一項IMBRUVICA的2期有效性和安全性研究結(jié)果,數(shù)據(jù)表明近一半(48%)的復(fù)發(fā)/難治性(R/R)邊緣區(qū)淋巴瘤(MZL)患者對IMBRUVICA單藥具有完全或部分應(yīng)答,結(jié)果是由獨立審查委員會(IRC)研究者評估的。
MZL是在淋巴組織邊緣處由白細胞(淋巴細胞)產(chǎn)生的緩慢生長的多樣化非霍奇金淋巴瘤。MZL約在成年人中占所有非霍奇金淋巴瘤病例的12%,并且中位年齡診斷為65歲。針對MZL患者,目前還沒有獲得批準的治療方案和治療標準。
這個2期研究在R/R MZL患者中評估了IMBRUVICA的安全性和功效。試驗的主要目的是衡量由IRC評估的ORR。反應(yīng)持續(xù)時間(DOR)、無進展生存期(PFS)、總生存期(OS)和安全性是次要目標。本研究的數(shù)據(jù)于2016年9月提交給美國FDA,作為補充新藥申請(sNDA)的一部分,以擴大IMBRUVICA的現(xiàn)有適應(yīng)癥。
在該多中心、開放標記試驗中,63名MZL患者(包括脾MZL、淋巴結(jié)MZL、和淋巴結(jié)外MZL亞型)接受一種或多種先前治療,包括至少一種CD20-介導(dǎo)免疫治療方案或利妥昔單抗治療。在研究中,79%的患者經(jīng)歷了部分腫瘤減少(63個患者中的50個),總體反應(yīng)率(ORR)為48%,這意味著BTK信號傳導(dǎo)是MZL中的重要生長和存活因子。初始反應(yīng)的中值時間為4.5個月。
我們衷心祝愿IMBRUVICA能夠獲得更廣的適應(yīng)癥標簽,造福更多的癌癥患者群體。


